
Dra. Milena Batalla
Ph. D.*
Panarum S.A.S., Argentina
Resumen
El receptor sigma-1 (S1R) es una chaperona que reside principalmente en las membranas del retículo endoplasmático (RE) asociadas a la mitocondria (MAM) y se lo considera un “modulador pluripotente” que desempeña un papel fundamental en el mantenimiento de la homeostasis neuronal. Dada su localización específica en el MAM, S1R juega un papel importante en la regulación de la función mitocondrial y es un blanco terapéutico en enfermedades mentales y neurodegenerativas, incluida epilepsia, la enfermedad de Alzheimer y la enfermedad de Parkinson. N,N-dimetiltriptamina (DMT), es el agonista endógeno del S1R, en tanto 5-MeO-DMT es un agonista farmacológico del S1R que produce altos niveles de disolución del ego definida también como “inmensidad oceánica”, índices más altos de satisfacción con la vida y calificaciones más bajas de depresión y estrés. In vitro, 5-MeO-DMT muestra una fuerte modulación de la plasticidad sináptica y celular en las neuronas. 5-MeO-DMT natural es agonista neurofarmacológico del S1R, está implicado en la activación bioenergética celular, y en la regulación epigenética y mecanismos antiapoptóticos de la función mitocondrial. S1R ha sido considerado como un controlador de la supervivencia y diferenciación celular en las neuronas. Los beneficios del uso farmacológico de 5-MeO-DMT totalmente natural están actualmente en investigación. Esta revisión destaca los mecanismos moleculares clave de los S1R en las funciones mitocondriales y las modificaciones epigenéticas involucradas en el desarrollo del fenotipo de la salud y la enfermedad neurodegenerativa, y describe el posible uso farmacológico del 5-MeO-DMT totalmente natural para “rescatar” a los pacientes del fenotipo de la enfermedad a través de la activación mitocondrial. Nos enfocamos en el compuesto 5-MeO-DMT totalmente natural, sus implicaciones y beneficios terapéuticos clínicas a largo plazo sobre la salud mental y el bienestar del paciente, posiblemente reprogramando y remodelando el epigenoma, considerando su aplicación particularmente en enfermedades mentales y neurodegenerativas.
Palabras clave: 5MeO-DMT natural, Receptor Sigma 1; mitocondrias; epigenética; terapia;
Introducción
Cientos de millones de personas en todo el mundo están afectadas por la pandemia de enfermedades mentales1 y neurodegenerativas2 con una prevalencia aproximada del 25%.
Los mismos profesionales de la salud tienen la presión y la exigencia acrecentada en las décadas más recientes debido a alta demanda. El acechante síndrome de burnout “Síndrome del Quemado” es una consecuencia que afecta a la salud mental de los médicos y profesionales de la salud en estas áreas. Particularmente, en Estados Unidos4,5 el burntout, en el área de psiquiatría ha sido etiquetado crisis nacional; y Europa6 y Argentina también consideran la problemática y tienen sus estudios y cifras al respecto.
La disfunción mitocondrial es un factor común en enfermedades crónicas mentales y neurodegenerativas. MAM (del inglés: mitochondrion-associated endoplasmic reticulum membrane), es fundamental para mantener la homeostasis neuronal. Así, dada la localización específica del S1R en el MAM, destacamos que la regulación del S1R sobre las disfunciones mitocondriales interviene en las enfermedades mentales y neurodegenerativas3.
Dada la localización específica del receptor sigma 1 (S1R) en el MAM se han explorado muchos reguladores de S1R en enfermedades mentales entre ellas depresión, esquizofrenia, trastorno obsesivo compulsivo; y neurodegenerativas incluyendo epilepsia, la enfermedad de Alzheimer (EA), la enfermedad de Parkinson (EP), entre otras3.
Los ligandos S1R son fundamentales en función mitocondrial. DMT es el agonista endógeno del receptor sigma 1 y, en particular, el papel de 5-MeO-DMT totalmente natural, es agonista farmacológico del receptor Sigma 17. La 5-metoxi-N,N-dimetiltriptamina totalmente natural, en lo sucesivo denominada 5-MeO-DMT totalmente natural, es una sustancia enteógena que se encuentra en la secreción de las glándulas paratiroides del sapo Bufo alvarius y es agonista del receptor Sigma 1. Actualmente se investiga la 5-MeO-DMT totalmente natural administrada en humanos en entornos naturalistas en el tratamiento de problemas de salud mental y medio para la exploración espiritual. Numerosas patentes y cinco estudios clínicos en curso describen los beneficios farmacológicos de 5-MeO-DMT8.
Las mitocondrias son la central eléctrica que proporciona la energía necesaria para los procesos que sustentan la vida9. Las mitocondrias realizan diversas funciones interconectadas, produciendo ATP y muchos intermediarios biosintéticos al mismo tiempo que contribuyen a las respuestas de estrés celular como la autofagia, la apoptosis y la regulación epigenética10. Las mitocondrias forman una red dinámica e interconectada que está íntimamente integrada con otros compartimentos celulares. Además, las funciones mitocondriales se extienden más allá de los límites de la influencia celular y la fisiología del organismo al regular la comunicación entre células y tejidos. Se demostró que la función mitocondrial y el metabolismo energético desempeñan un papel importante en la regulación de los comportamientos sociales11.
Receptor sigma 1 y su control mitocondrial en enfermedades neurodegenerativas El S1R es una chaperona pequeña de 28 kDa, altamente conservada, que reside principalmente en la membrana del retículo endoplásmico (RE) asociado a la mitocondria MAM y es un modulador pluripotente dinámico en sistemas vivos12.
El receptor S1R tiene un perfil farmacológico único y versátil7,13,14, S1R se une con gran afinidad a varias clases de ligandos no relacionados químicamente: los neuroesteroides15, los neurolépticos, los dextrobenzomorfanos [DEX]15 y varios psicoestimulantes como la cocaína15, la metanfetamina [METH]15,16, la metilendioximetanfetamina [MDMA]17 y la metacatinona15,18. Se cree que el S1R puede mediar los efectos inmunosupresores, antipsicóticos19 y neuroprotectores de muchos fármacos20. Los S1R regulan varios sistemas de neurotransmisores, incluidos el glutamatérgico [Glu], dopaminérgico [DA], serotoninérgico [5HT], noradrenérgico [NE] y sistemas colinérgicos [Ch]. Dado que estos transmisores, que interactúan con los S1R, están implicados en muchos trastornos neuropsiquiátricos, se ha evaluado su papel en varios de estos trastornos21. De hecho, varias líneas de investigación han demostrado que S1R juega un papel en la fisiopatología neuropsiquiátrica en trastornos del estado de ánimo22, los trastornos de ansiedad19 y la esquizofrenia23,24.
S1R participa en la remodelación de la membrana y la diferenciación celular en la reconstitución del sistema nervioso en el cerebro implicado en el abuso de drogas25. El S1R es influencia en el metabolismo de la glucosa cerebral, S1R tiene una actividad biológica constitutiva, y los ligandos de S1R funcionarían siendo moduladores de la actividad innata de esta proteína. La falta de desarrollo posnatal de S1R en el SNC y el hecho de que los sitios S1R sean mucho más densos en órganos periféricos, como el hígado26, tejidos inmunitarios y endocrinos27,28, sugieren un papel universal para los S1R en la función celular.
Las enfermedades neurodegenerativas con distintas etiologías genéticas y fenotipos patológicos parecen compartir mecanismos comunes de disfunción celular neuronal, que incluyen excitotoxicidad, desregulación del calcio, daño oxidativo, estrés del RE y disfunción mitocondrial29-31.
Los S1R también influyen en la expresión de señales antiapoptóticas y proapoptóticas que se dirigen a las mitocondrias. La actividad de S1R regula positivamente la expresión de Bcl-2, posiblemente a través del factor nuclear kappa B (NF-kB) y/o las vías de la quinasa regulada por señales extracelulares (ERK)32,33. Dado que también se ha demostrado que Bcl-2 interactúa con los IP3R y mejora su actividad33, esta regulación positiva del nivel de Bcl-2 es otro mecanismo por el cual la actividad de sigma 1 aumenta la captación de calcio mitocondrial mediada por IP3R y la producción de ATP, además de la Interacción S1R y IP3R descrita anteriormente. La activación de S1R también disminuye la expresión de Bax y las caspasas asociadas a la apoptosis, lo que promueve aún más la supervivencia celular3,34,35.
La enfermedad de Alzheimer (EA) es una enfermedad compleja y multifactorial caracterizada por un deterioro cognitivo severo y pérdida de memoria. Se observaron niveles reducidos de proteína S1R en el tejido cerebral post-mortem cortical y vivo humano36,37 y se encontraron resultados similares en estudios de tomografía por emisión de positrones, en los que las expresiones de S1R fueron más bajas en el cerebro de pacientes con EA temprana38. La expresión de S1R puede estar involucrada en el efecto terapéutico del inhibidor de HDAC6 en la patología de EA39. Las evidencias preclínicas sugieren que los agonistas de S1R son útiles en el tratamiento de la EA. Cabe considerar, que el 5-MeO-DMT7 totalmente natural agonista del receptor sigma 1 tiene ventajas a considerar en la aplicación en clínica.
La enfermedad de Parkinson (EP) es un trastorno de progresión lenta que provoca funciones motoras deterioradas, como bradicinesia o temblor, y otras complicaciones no motoras. La característica patológica de la EP es la muerte masiva de neuronas dopaminérgicas en la sustancia negra pars compacta (SNpc) y el depósito de cuerpos de Lewy compuestos por α-sinucleína, ubiquitina y neurofilamentos. Los S1R endógenos inhiben tónicamente la activación de NF-κB inducida por DA, y protege a las células de la muerte. Por lo tanto, los ligandos S1R pueden representar nuevos objetivos terapéuticos para EP3. Los S1R son uno de los sustratos endógenos que contrarrestan la citotoxicidad de la dopamina que, de otro modo, provocaría la apoptosis40.
Metodología
En esta revisión, los artículos citados se identificaron a partir de Búsquedas en MEDLINE (PubMed) que abarcan el período de 1961 a 2024 con palabras clave “DMT’, “5-meo-dmt” «Sigma receptor» “eficacia” y «seguridad», obtenidos de las referencias de artículos recuperados e identificados a través del conocimiento propio de la autora. La selección final de material que se consideró relevante para este artículo es responsabilidad del autor. Los resultados de la búsqueda se cotejaron con revisiones anteriores y listas de referencias, fueron revisados a mano. Los hallazgos se sintetizaron utilizando un enfoque de síntesis narrativa. Esta revisión considera la farmacología, la química y el metabolismo de 5-MeO-DMT, estudios epidemiológicos, beneficios informados y efectos adversos.
DMT endógeno y el 5-MeO-DMT natural son agonistas del receptor sigma 1
El DMT endógeno es un agonista del receptor Sigma 1, una molécula sintetizada, almacenada, liberada y agonista de S1R41 en las células del sistema nervioso periférico y del sistema nervioso central42. El DMT es considerado un posible neurotransmisor del SNC implicado en la percepción sensorial43. La enzima indoletilamina-N-metiltransferasa (INMT), es la responsable de la síntesis de DMT44. La INMT se expresa ampliamente en el cuerpo, principalmente en tejidos periféricos como los pulmones, la tiroides y las glándulas suprarrenales, el músculo esquelético, el corazón, el intestino delgado, el estómago, la retina, el páncreas, los ganglios linfáticos y la sangre. Se localiza densamente en la asta anterior de la médula espinal44.
DMT agonista del S1R41 es neuroprotector a través de varios mecanismos. DMT y también 5-MeO-DMT redujeron la inflamación a través de S1R e indujeron plasticidad neuronal45, en un proceso regenerativo a largo plazo que va más allá de la neuroprotección46. DMT y 5-MeO-DMT modulan las respuestas inflamatorias innatas y adaptativas a través del S1R de células dendríticas derivadas de monocitos humanos47.
La actividad de S1R mediada por DMT induce cambios en la plasticidad neuronal en los recién nacidos48. El DMT exógeno estimula la diferenciación in vitro de progenitores neuronales hacia un fenotipo neuronal a través de S1R. La acción in vivo de DMT mediada por S1R mejoró el rendimiento en tareas de aprendizaje que se ha relacionado con la neurogénesis del hipocampo. Además, estudios previos realizados en humanos49, utilizando la medicina tradicional de los pueblos originarios de América del Sur Ayahuasca cuyo componente principal en la infusión es el DMT50 tiene actividad antidepresiva, efecto terapéutico generalmente ligado a la neurogénesis del hipocampo51.
El 5-MeO-DMT totalmente natural se encuentra como un extracto natural de las secreciones de la glándula del sapo Bufo alvarius del desierto de Sonora y se considera una medicina amerindia Seris, un grupo aborigen del estado de Sonora, en México8. Algunos reportes sugieren que la secreción del sapo Bufo alvarius ha sido utilizada históricamente por pueblos originarios del territorio suroeste de Estados Unidos y norte de México52. Este agonista enteogénico del receptor sigma 1 se ha asociado recientemente con ganancias cognitivas, efectos antidepresivos y cambios en áreas del cerebro relacionadas con la atención y la regeneración neuronal53. El 5-MeO-DMT es una sustancia neurorreguladora, el receptor sigma-17 es su diana neurofarmacológica. 5-MeO-DMT es el agente enteógeno más potente con una fuerte disolución del ego54, influencia en la percepción8, activación bioenergética celular, antiapoptótico10 y activador mitocondrial epigenético. El mecanismo de acción de 5-MeO-DMT está mediado por la vía de señalización S1R, un «modulador pluripotente» en los sistemas vivos, controlador de la supervivencia, diferenciación celular y de la función mitocondrial14,55. El 5-MeO-DMT natural es una luz de esperanza en la terapia de recuperación de la salud de pacientes con enfermedades mentales y enfermedades neurodegenerativas.
Se han realizado estudios farmacológicos in vivo de 5-MeO-DMT56 en ratones, ratas, jerbos, hámsteres, cobayos, conejos, peces dorados, gatos, perros, ovejas, cerdos y primates8. Se ha estudiado la farmacocinética de 5-MeO-DMT: después de una inyección intraperitoneal (IP), Cmax = 5–10 min y t1/2 = 6–16 min en ratas. 5-MeO-DMT cruza fácilmente la barrera hematoencefálica (BBB). El 5-MeO-DMT se distribuye al hígado, los riñones y el cerebro. Se ha demostrado que la farmacocinética de 5-MeO-DMT sigue un patrón no lineal para la administración tanto IP como intravenosa (IV) de dosis altas en ratones. Esta no linealidad también se refleja en los aumentos correspondientes en la concentración cerebral de 5-MeO-DMT.
Específicamente, 5-MeO-DMT modula proteínas asociadas con la potenciación a largo plazo, fortalecimiento persistente de la sinapsis basado en patrones recientes de actividad. Las proteínas que se encuentran reguladas al alza por 5-Meo-DMT son NMDAR, CaMK2 (Ca2+/proteína quinasa dependiente de calmodulina) y CREB (proteína de unión a elementos sensibles al AMP cíclico)57.
S1R contribuye a los efectos de plasticidad cerebral de 5-MeO-DMT. S1R es un regulador endógeno de la morfología de las espinas dendríticas y del crecimiento de neuronas58,59. 5-MeO-DMT es un mediador molecular directo de la plasticidad, que tiene efectos sobre la superficie celular y las proteínas extracelulares involucradas en la regulación de la arquitectura sináptica. Se observó una regulación positiva de integrinas7, netrin receptor, plexinas y semaforinas en organoides tratados con 5-MeO-DMT, también se encontró en pacientes con trastorno depresivo mayor que respondieron bien a los antidepresivos, lo que sugiere la importancia de esta clase de proteínas en la plasticidad cerebral60. Los agonistas de S1R ejercen efectos neuroprotectores al regular los niveles de calcio intracelular61, previenen la expresión de genes proapoptóticos70 y proteger el ARNm contra genes antiapoptóticos como Bcl-23. Los posibles efectos psicológicos, como cambios en la percepción y el pensamiento, renovada sensación de novedad, inefabilidad y asombro34, se derivan directamente de la fuerte modulación de la plasticidad sináptica y celular promovida por 5-MeO-DMT.
Cambios epigenéticos dirigidos por mitocondrias y el papel de 5-MeO-DMT
Los efectos neuroprotectores, de neuroregeneración, antiapoptosis y neuroplasticidad62 del agonista S1R de 5-MeO-DMT están mediados a través de la vía de regulación epigenética mitocondrial. Cada neurona contiene hasta 2 millones de mitocondrias63. El cerebro hambriento de energía es especialmente vulnerable a los problemas de la central eléctrica durante el daño mitocondrial64. La regulación mitocondrial de las alteraciones del paisaje epigenético es reversible, los procesos epigenéticos tempranos en la vida podrían desempeñar un papel en la definición de las trayectorias interindividuales del comportamiento humano y los mecanismos epigenéticos contribuyen a la disfunción y enfermedad neurológica de aparición tardía65. Algunos objetivos de enfermedades epigenéticas con muerte neuronal significativa y disfunción neurológica incluyen la enfermedad de Alzheimer (AD), la enfermedad de Parkinson (EP), la enfermedad de Huntington (HD), la epilepsia, el accidente cerebrovascular y la lesión cerebral traumática (TBI)66. Las alteraciones del gen S1R se han asociado con trastornos neurodegenerativos graves67.
La metilación del ADN es una importante modificación epigenética de la expresión génica del ADN, regulada por las mitocondrias35. Las modificaciones epigenéticas dentro del genoma nuclear de los mamíferos incluyen la metilación del ADN (5-mC) o la hidroximetilación (5-hmC)68,69. Recientemente se ha identificado que las mitocondrias de mamíferos tienen actividad de ADN mitocondrial metiltransferasa 1 (mtDNMT1), 5-mC y 5-hmC. La translocación identificada de DNMT1 nuclear a la matriz mitocondrial está regulada por la expresión de una secuencia dirigida a las mitocondrias conservada, aguas arriba del sitio de inicio de la transcripción del gen dentro del gen codificado nuclear70. Las alteraciones en mtDNMT1 afectan directamente la transcripción de las hebras ligeras y pesadas de mtDNA, lo que sugiere una correlación entre la regulación transcripcional mediada por 5-hmC y 5-mC de mtDNA por un gen codificado nuclear. Estos hallazgos proporcionan nueva evidencia que implica la regulación epigenética del genoma mitocondrial por mtDNMT1 translocado codificado nuclearmente en relación con la disfunción mitocondrial71-73. Los niveles reducidos de cofactores debido al deterioro/disfunción mitocondrial podrían tener efectos significativos en la regulación del genoma nuclear. Las disfunciones mitocondriales invocan respuestas retrógradas de mitocondrias a núcleo en células humanas74. La metilación reducida del mtDNA es el resultado o una consecuencia de esta disfunción mitocondrial.
La impronta epigenética mitocondrial materna y la impronta epigenética cromosómica de los patrones de los padres representan una memoria biológica de lo que experimentaron los padres75: la transmisión es causada por factores ambientales y el comportamiento de crianza de los padres76. Que estos efectos transgeneracionales también se han transmitido epigenéticamente a sus hijos. Al integrar factores hereditarios y ambientales a lo largo de la vida, la epigenética agrega una nueva y más completa comprensión de la transmisión transgeneracional de trauma77, pesadillas78, trastorno de estrés postraumático PTSD79, síntomas de enfermedades mentales y neurodegeneración. Además, la transmisión puede continuar más allá de la segunda generación, incluir a los nietos, bisnietos y quizás también a otros. Este proceso de transmisión transgeneracional del trauma (TTT) ha sido descrito en continuidad en la literatura académica durante más de medio siglo78. Las marcas epigenéticas afectan los patrones de expresión génica en el sistema nervioso y la disfunción mitocondrial y el desequilibrio epigenético parecen influir en la progresión de muchos trastornos mentales y neurológicos75. Posiblemente, el 5-MeO-DMT8 agonista S1R7 regula mediante la activación de la vía mitocondrial reversible la restauración de funciones celulares saludables al restaurar el paisaje epigenético.
La enfermedad de Alzheimer familiar de aparición temprana (EA) es más probable en individuos que provienen de madres diagnosticadas con EA que de padres diagnosticados con EA. Estudios en modelos animales han demostrado que la impronta materna en el óvulo conduce a alteraciones genéticas y epigenéticas en el ADN nuclear y mitocondrial. Estas modificaciones que se transmiten a los nuevos seres vivos afectan más a las proteínas mitocondriales y, por tanto, la función mitocondrial puede verse afectada en la edad adulta por tendencias presentes desde el óvulo80.
En nuestra perspectiva, es posible la activación del mecanismo epigenético10 a través de S1R y la función mitocondrial en enfermedades mentales y neurodegenerativas, cuya activación por el agonista 5-MeO-DMT promueve la activación de las vías mitocondriales, la función bioenergética mitocondrial81–84, la respiración oxidativa mitocondrial85 y la regulación epigenética mitocondrial, restaura la actividad nuclear mtDNMT, aumentando los niveles mitocondriales FAD y cofactores α-KG que tienen efectos significativos en la regulación del genoma nuclear. 5-MeO-DMT modula las proteínas involucradas en la potenciación a largo plazo (LTP), la morfogénesis y maduración de las espinas dendríticas, al tiempo que inhibe la neurodegeneración y la apoptosis. 5-MeO-DMT activa la puntuación para la columna dendrítica y la formación de protuberancias celulares, microtúbulos y organización del citoesqueleto. Las funciones biológicas como la neurodegeneración, la apoptosis y la lesión neuronal son inhibidas por 5-MeO-DMT4 a través de la vía S1R-mitocondria.
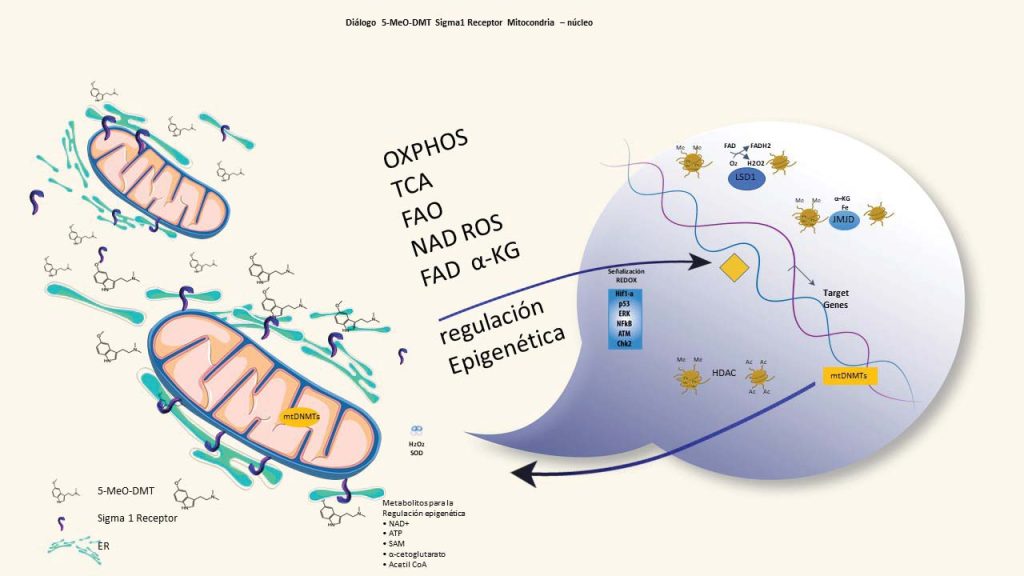
Figura 1. Diálogo entre mitocondrias y núcleo. Regulación epigenética nuclear/modificación de cromatina del agonista 5-MeO-DMT del receptor Sigma 1, a través de mitocondrias, a través de sirtuinas que requieren acetil CoA del ciclo TCA; detección de nutrientes a través de la detección de NAD+/NADH y ATP/AMP; catálisis usando cofactores FAD y α-cetoglutarato sintetizados en mitocondrias. Reparación del ADN y vías de señalización redox. Las mtDNMT están asociadas con mitocondrias sanas. La reducción metilación del mtDNA es el resultado de la disfunción mitocondrial.
Impacto terapéutico del 5-MeO-DMT natural
El 5-MeO-DMT natural85 es un agente enteógeno con efectos alta potencia, de inicio ultrarrápido y de corta duración, es un agonista del receptor sigma 1. Los pueblos originarios de América del Norte, Central y del Sur, incluida la región amazónica de América, posiblemente utilizaron la medicina ancestral en milenarios rituales sagrados con fines de curación y evolución de la consciencia según su cosmovisión. 5-MeO-DMT totalmente natural produce un profundo estado alterado de conciencia y disolución del ego, incluidas experiencias místicas como experiencias internas que implican un desvanecimiento intensamente sentido del sentido del yo y/o sentimientos de mayor conexión, hasta e incluyendo el sentido de completa unidad86. Este tipo de sentimientos van mucho más allá de nuestro sentido normal del día a día de la autoconsciencia. En la consciencia ordinaria, generalmente existe la impresión de que hay un yo por un lado y luego, por otro lado, todo lo demás. Sin embargo, en algunas circunstancias, durante esos momentos, el sentido de uno mismo puede desvanecerse y convertirse en parte de todo lo demás, en lugar de estar separado de él86, con efectos beneficiosos a largo plazo sobre la salud mental y el bienestar del paciente85.
En el uso medicinal naturalista de la secreción de sapo que contiene 5-MeO-DMT, se informó que la intensidad de la experiencia está asociada con mejoras en las medidas de satisfacción con la vida y la reducción de la angustia psicológica en participantes sin una condición de salud mental subyacente87. Los efectos que siguen a la administración natural de 5-MeO-DMT son alteración en la percepción auditiva y del tiempo, amplificación de los estados emocionales y fuerte disolución del ego y de corta duración, e induce una experiencia espiritual mística «pico»87 confiable considerado un estado predictor central de la eficacia del enteógeno totalmente natural 5-MeO-DMT85. 5-MeO-DMT causa reducciones rápidas y sostenidas en los síntomas de depresión, ansiedad y estrés. El 5-MeO-DMT también estimula la función neuroendocrina y la inmunorregulación56.
Las formulaciones de interés son para administración vía fumada, vapeada, inhalatoria, intramuscular (IM), intranasal e intravenosa por su alta biodisponibilidad de 5-MeO-DMT porque evitan el metabolismo de primer paso. La administración fumada y vaporizada proporciona un inicio rápido de experiencias subjetivas de alta intensidad y corta duración. En la actualidad, las empresas biofarmacéuticas interesadas en la 5-MeO-DMT sintética están explorando y desarrollando formulaciones vaporizadas, intranasales, IM e intravenosas para administrar 5-MeO-DMT87,88. En un ensayo clínico de Fase I de rango de dosis para evaluar la seguridad y los efectos psicoactivos de 5-MeO-DMT, se demostró la seguridad de la dosificación vaporizada de hasta 18 mg para la administración por inhalación. Es importante destacar que el inicio rápido y la corta duración de la experiencia de 13 a 18 minutos aproximadamente con 5-MeO-DMT la hacen más adecuada para las estrategias individuales de estudios de dosis en comparación con los psicoactivos de acción más prolongada89.
La implicación clínica en dosis o microdosis del agonista del 5-MEO-DMT natural del receptor sigma y su papel en la activación mitocondrial abre un nuevo abanico de oportunidades que se aplique a la terapia de trastornos psiquiátricos graves en esquizofrenia (SCZ), trastorno depresivo mayor (MDD) y trastorno límite de la personalidad (TLP) enfermedades con diferente rango de síntomas debilitantes y pronóstico, y muestran alteraciones similares en los procesos del metabolismo energético90. Los datos proteómicos muestran que SCZ y BPD comparten 32 proteínas alteradas, en su mayoría relacionadas con el transporte de electrones mitocondrial, la respuesta a ROS y la glucólisis. Comparten algunos rasgos fisiopatológicos y el análisis de datos reveló siete proteínas alteradas tanto en BPD como en MDD, mientras que cinco de ellas son subunidades diferentes del complejo NADH deshidrogenasa en la cadena de transporte de electrones91. Esto es consistente con informes previos sobre el funcionamiento deficiente de los complejos OXPHOS en MDD90,91 y la disminución de la expresión nuclear de genes que codifican los mecanismos respiratorios mitocondriales en BPD92, los cuales conducen a una producción de energía mitocondrial reducida. La depresión mayor se ha descrito como el síntoma inicial de la enfermedad mitocondrial en una muestra grande de pacientes adultos93. Tal se mencionó al inicio, se demostró que la función mitocondrial y el metabolismo energético desempeñan un papel importante en la regulación de los comportamientos sociales8. La producción limitada de energía afecta la capacidad neuronal adaptativa y contribuye al desarrollo de psicopatologías como SCZ, BPD y MDD bajo estímulos estresantes94.
La composición patentada de 5-MeO-DMT totalmente natural comprende su posible uso en la terapia ante enfermedades mentales y neurodegenerativas85. Uno de los usos informados más beneficiosos e importantes del 5-MeO-DMT totalmente natural es la recuperación del paciente de la adicción provocada por la cocaína8. La cocaína mediada por S1R tiene una interacción dependiente de la dosis entre la histona desacetilasa (HDAC)1, HDAC3 y HDAC3 y, por lo tanto, afecta la compactación de la cromatina y la expresión génica146. 5-MeO-DMT completamente natural a través de la activación de S1R desencadena la recuperación de los síntomas de los pacientes con mejoras persistentes en la satisfacción con la vida y extinción de los síntomas psicopatológicos85,87,95-97.
Una dosis única, un tratamiento de 24 horas con 5-MeO-DMT, mostró una importante regulación a la baja de mGluR5 después del tratamiento con 5-MeO- DMT. mGluR5 tiene un papel en los efectos gratificantes de varias drogas de abuso. Se demostró que los ratones que carecen del gen mGluR5 no se autoadministran cocaína y no muestran hiperactividad inducida por la cocaína98. También han atenuado los signos somáticos de abstinencia de la nicotina y han reducido el comportamiento de consumo de etanol99, lo que sugiere que mGluR5 está involucrado en la adicción4,100.
5-MeO-DMT natural agonista del receptor sigma 1 está involucrado en la recuperación y curación informada de recuerdos traumáticos85,101: “Las modificaciones epigenéticas, como la metilación del ADN, ocurren en respuesta a las influencias ambientales para alterar la expresión funcional de los genes en un estado duradero y transmisible intergeneracionalmente. Como tales, explican la variación interindividual, así como los efectos duraderos de la exposición al trauma”79. La reconsolidación y la extinción del miedo de los recuerdos traumáticos requieren la participación de mecanismos epigenéticos. Varios países donde el 5-MeO-DMT no está regulado ofrecen retiros y programas de tratamiento102. Una encuesta de 51 veteranos de las Fuerzas de Operaciones Especiales de EE. UU. de uno de esos retiros, con tratamientos combinados de 5-MeO-DMT natural proveniente de Bufo alvarius e ibogaína, indicó que la experiencia fue terapéutica para sus experiencias traumáticas, ideación suicida, depresión y ansiedad100,102. En una encuesta de 20 personas del mismo centro de retiro, el 75% reportó una ‹experiencia mística completa›, medida por MEQ-30100,103.
Las características notables del 5-MeO-DMT natural son las altas tasas informadas de disolución del ego y experiencias místicas predictor de eficacia, con resultados terapéuticos positivos a largo plazo que requieren una farmacognosia y una investigación clínica y farmacológica consistente103. Algunos de los beneficios relacionados con el 5-MeO-DMT natural mediado por S1R es activación mitocondrial para extinguir los síntomas de algunos trastornos psiquiátricos104 y neurodegenerativos105 están relacionados posiblemente con modificaciones epigenéticas producidas por la vía epigenética mitocondrial del 5-MeO-DMT-S1R. El 5-MeO-DMT natural ligando del S1R es de gran interés terapéutico para su aplicación en pacientes con enfermedades mentales93 y neurodegenerativas.
Conclusión
Las enfermedades mentales y neurodegenerativas se desarrollan producto de una compleja regulación epigenética del estrés ambiental y de la herencia epigenética manifestados y controlados por receptor Sigma 1-MAM- mitocondria con un alto grado de variación fenotípica dependiendo del tipo neuronal afectado. El DMT endógeno y el DMT exógeno son agonistas del receptor sigma 1 y regulan la neurogénesis adulta, comprobado in vitro e in vivo con beneficios para la salud mental y efectos antidepresivos en pacientes. El nuevo y potente agonista farmacológico del receptor sigma 1 es el 5-MeO-DMT natural. El 5-MeO-DMT natural produce una fuerte reprogramación neurobiológica a través del receptor Sigma 1 que controla el flujo de Ca2+ de las mitocondrias, las respuestas bioenergéticas, oxidativas, de estrés y la regulación epigenética que ejerce la función mitocondrial en neuronas. De todo lo expuesto, considero que gracias al eficiente mecanismo de acción y a las implicancias terapéuticas del 5-MeO-DMT natural demostrados en el uso ancestral, el 5-MeO-DMT natural ha despertado fuertemente la atención de la investigación básica y clínica. La investigación básica y clínica del 5-MeO-DMT natural, una molécula de uso ancestral, ha permitido la comprensión de su mecanismo de acción y la validación de la eficacia terapéutica. El uso medicinal legal del 5-MeO-DMT natural está ganando posiciones en la consideración clínica. El uso medicinal legal del 5-MeO-DMT natural es un cambio de paradigma que se direcciona a ser la respuesta terapéutica eficaz ante enfermedades mentales y neurodegenerativas.
REFERENCIAS
- Ferrari A.J., Santomauro D.F., Herrera A.M.M., et al. Global, regional, and national burden of 12 mental disorders in 204 countries and territories, 1990–2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Psychiatry 2022; 9: 137–150.
- Carroll W.M. The global burden of neurological disorders. Lancet Neurol. 2019; 18: 418-419.
- Nguyen L., Lucke-Wold B.P., Mookerjee S.A., et al. Role of sigma-1 receptors in neurodegenerative diseases. J. Pharmacol. Sci. 2015; 127: 17–29.
- McFarland et al. Update on Addressing Mental Health and Burnout in Physicians: What Is the Role for Psychiatry? Curr Psychiatry Rep.; 2020, 21(11): 108.
- Richard F. Summers, et al. Well-Being, Burnout, and Depression Among North American Psychiatrists: The State of Our Profession Am J Psychiatry 2020; 177:955–964.
- K. O’Connor et al. Burnout in mental health professionals: A systematic review and meta-analysis of prevalence and determinants. European Psychiatry, 2018; 53, 74–99.
- Dakic V., Minardi Nascimento J., Costa Sartore R., et al. Short-term changes in the proteome of human cerebral organoids induced by 5-MeO-DMT. Sci. Rep. 2017; 7: 12863.
- Ermakova A.O., Dunbar F., Rucker J., et al. A narrative synthesis of research with 5-MeO-DMT. J. Psychopharmacol. 2022; 36: 273–294.
- Nunnari J., Suomalainen A. Mitochondria: in sickness and in health. Cell 2012; 148: 1145–1159.
- Minocherhomji S., Tollefsbol T.O., Singh K.K. Mitochondrial regulation of epigenetics and its role in human diseases. Epigenetics 2012; 7: 326–334.
- Hollis F., van der Kooij M.A., Zanoletti O., et al. Mitochondrial function in the brain links anxiety with social subordination. Proc. Natl. Acad. Sci. U.S.A. 2015; 112: 15486–15491.
- Mori T., Hayashi T., Hayashi E., et al. Sigma-1 receptor chaperone at the ER-mitochondrion interface mediates the mitochondrion-ER-nucleus signaling for cellular survival. PLoS ONE 2013; 8: e76941.
- Hayashi T. The sigma-1 receptor in cellular stress signaling. Front. Neurosci. 2019; 13: 733.
- Rousseaux C.G., Greene S.F. Sigma receptors [σ Rs]: biology in normal and diseased states. J. Recept. Signal Transduct. 2015; 1–62.
- Bastianetto S., Ramassamy C., Poirier J., et al. Dehydroepiandrosterone (DHEA) protects hippocampal cells from oxidative stress-induced damage. Mol. Brain Res. 1999; 66: 35–41.
- Kaushal N., R. Matsumoto R. Role of sigma receptors in methamphetamine-induced neurotoxicity. Curr. Neuropharmacol. 2011; 9: 54–57.
- Kaushal N., Seminerio M.J., Shaikh J., et al. CM156, a high affinity sigma ligand, attenuates the stimulant and neurotoxic effects of methamphetamine in mice. Neuropharmacology 2011; 61: 992–1000.
- Brammer M.K., Gilmore D.L., Matsumoto R.R. Interactions between 3,4-methylenedioxymethamphetamine and σ1 receptors. Eur. J. Pharmacol. 2006; 553: 141–145.
- Meririnne E., Kankaanpää A., Lillsunde P., et al. The effects of diazepam and zolpidem on cocaine- and amphetamine-induced place preference. Pharmacol. Biochem. Behav. 1999; 62: 159–164.
- Cormaci G., Mori T., Hayashi T., et al. Protein kinase a activation down-regulates, whereas extracellular signal-regulated kinase activation up-regulates σ-1 receptors in B-104 cells: implication for neuroplasticity. J. Pharmacol. Exp. Ther. 2007; 320: 202–210.
- Cobos E., Entrena J., Nieto F., et al. Pharmacology and therapeutic potential of sigma1 receptor ligands. Curr. Neuropharmacol. 2008; 6: 344–366.
- Paschos K.A., Veletza S., Chatzaki E. Neuropeptide and sigma receptors as novel therapeutic targets for the pharmacotherapy of depression. CNS Drugs 2009; 23: 755–772.
- Carmichael, J. et al. Bacterial and yeast chaperones reduce both aggregate formation and cell death in mammalian cell models of huntington’s disease. Proc. Natl. Acad. Sci. (2000) 97, 9701-9705.
- Su T.-P., Hayashi T., Vaupel D.B. When the endogenous hallucinogenic trace amine N,N-dimethyltryptamine meets the sigma-1 receptor. Sci. Signal. 2009; 2: pe12.
- Hayashi T., Su T.-P. The potential role of sigma-1 receptors in lipid transport and lipid raft reconstitution in the brain: implication for drug abuse. Life Sci. 2005; 77: 1612–1624.
- Wolfe S.A., Culp S.G., De Souza E.B. σ-Receptors in endocrine organs: identification, characterization, and autoradiographic localization in rat pituitary, adrenal, testis, and ovary. Endocrinology 1989; 124: 1160–1172.
- Wolfe S.A., Kulsakdinun C., Battaglia G., et al. Initial identification and characterization of sigma receptors on human peripheral blood leukocytes. J. Pharmacol. Exp. Ther. 1988; 247: 1114–1119.
- Narayanan S., Mesangeau C., Poupaert J.H., et al. Sigma receptors and cocaine abuse. Curr. Top. Med. Chem. 2011; 11: 1128–1150.
- Al-Saif A., Al-Mohanna F., Bohlega S. A mutation in sigma-1 receptor causes juvenile amyotrophic lateral sclerosis. Ann. Neurol. 2011; 70: 913–919.
- Luty A.A., Kwok J.B., Dobson-Stone C., et al. Sigma nonopioid intracellular receptor 1 mutations cause frontotemporal lobar degeneration-motor neuron disease. Ann. Neurol. 2010; 68: 639–649.
- Vance J.E. MAM (mitochondria-associated membranes) in mammalian cells: lipids and beyond. Biochim. Biophys. Acta BBA – Mol. Cell Biol. Lipids 2014; 1841: 595–609.
- Rizzuto R., Marchi S., Bonora M., et al. Ca2+ transfer from the ER to mitochondria: when, how and why. Biochim. Biophys. Acta BBA – Bioenerg. 2009; 1787: 1342–1351.
- Tchedre K.T., Yorio T. σ-1 Receptors protect RGC-5 cells from apoptosis by regulating intracellular calcium, Bax levels, and Caspase-3 activation. Investig. Opthalmology Vis. Sci. 2008; 49: 2577.
- Smiraglia D., Kulawiec M., Bistulfi G.L., et al. A novel role for mitochondria in regulating epigenetic modifications in the nucleus. Cancer Biol. Ther. 2008; 7: 1182–1190.
- Hedskog L., Pinho C.M., Filadi R., et al. Modulation of the endoplasmic reticulum-mitochondria interface in AD and related models. Proc. Natl. Acad. Sci. U.S.A. 2013; 110:7916e7921.
- Jansen K.L., Faull R.L., Storey P., et al. Loss of sigma binding sites in the CA1 area of the anterior hippocampus in AD correlates with CA1 pyramidal cell loss. Brain Res. 1993; 623: 299e302.
- Mishina M., Ohyama M., Ishii K., et al. Low density of sigma1 receptors in early Alzheimer’s disease. Ann. Nucl. Med. 2008; 22: 151-156.
- Iwamoto M., Nakamura Y., Takemura M., et al. TLR4-TAK1-p38 MAPK pathway and HDAC6 regulate the expression of sigma-1 receptors in rat primary cultured microglia. J. Pharmacol. Sci. 2020; 144: 23–29.
- Mori T., Hayashi T., Su T.-P. Compromising σ-1 receptors at the endoplasmic reticulum render cytotoxicity to physiologically relevant concentrations of dopamine in a Nuclear Factor-κB/Bcl-2-dependent mechanism: potential relevance to Parkinson’s disease. J. Pharmacol. Exp. Ther. 2012; 341: 663–671.
- Fontanilla D., Johannessen M., Hajipour A.R., et al. The hallucinogen N,N-dimethyltryptamine (DMT) is an endogenous sigma-1 receptor regulator. Science 2009; 323: 934–937.
- Carbonaro T.M., Gatch M.B. Neuropharmacology of N,N-dimethyltryptamine. Brain Res. Bull. 2016; 126: 74–88.
- Wallach J.V. Endogenous hallucinogens as ligands of the trace amine receptors: a possible role in sensory perception. Med. Hypotheses 2009; 72: 91–
- Nichols D.E. N,N -Dimethyltryptamine and the pineal gland: separating fact from myth. J. Psychopharmacol. (Oxf.) 2018; 32: 30–36.
- Kourrich S., Su T.-P., Fujimoto M., et al. The sigma-1 receptor: roles in neuronal plasticity and disease. Trends Neurosci. 2012; 35: 762–771.
- Ruscher K., Shamloo M., Rickhag M., et al. The sigma-1 receptor enhances brain plasticity and functional recovery after experimental stroke. Brain 2011; 134: 732–746.
- Szabo A., Kovacs A., Frecska E., et al. Psychedelic N,N-dimethyltryptamine and 5-methoxy-N,N-dimethyltryptamine modulate innate and adaptive inflammatory responses through the sigma-1 receptor of human monocyte-derived dendritic cells. PLoS ONE 2014; 9: e106533.
- Ruscher K., Shamloo M., Rickhag M., et al. The sigma-1 receptor enhances brain plasticity and functional recovery after experimental stroke. Brain 2011; 134: 732–746.
- Osório F. de L., Sanches R.F., Macedo L.R., et al. Antidepressant effects of a single dose of ayahuasca in patients with recurrent depression: a preliminary report. Braz. J. Psychiatry (Rev. Bras. Psiquiatry) 2015; 37: 13–20.
- Uthaug M.V., Mason N.L., Toennes S.W., et al. A placebo-controlled study of the effects of ayahuasca, set and setting on mental health of participants in ayahuasca group retreats. Psychopharmacology (Berl.) 2021; 238: 1899–1910.
- Morales-Garcia J.A., Calleja-Conde J., Lopez-Moreno J.A., et al. N,N-Dimethyltryptamine compound found in the hallucinogenic tea ayahuasca, regulates adult neurogenesis in vitro and in vivo. Transl. Psychiatry 2020; 10: 331.
- Weil A.T., Davis W. Bufo alvarius: a potent hallucinogen of animal origin. J. Ethnopharmacol. 1994; 41: 1–8.
- Hitchler M.J., Domann F.E. Redox regulation of the epigenetic landscape in cancer: a role for metabolic reprogramming in remodeling the epigenome. Free Radic. Biol. Med. 2012; 53: 2178–2187.
- Sleight F.G., Lynn S.J., Mattson R.E., et al. A novel ego dissolution scale: a construct validation study. Conscious. Cogn. 2023; 109: 103474.
- Hayashi T., Su T.-P. Sigma-1 receptor chaperones at the er- mitochondrion interface regulate Ca2+ signaling and cell survival. Cell 2007; 131: 596–610.
- Sitaram B.R., Lockett L., Talomsin R., et al. In vivo metabolism of 5-methoxy-N,N-dimethyltryptamine and N,N-dimethyltryptamine in the rat. Biochem. Pharmacol. 1987; 36: 1509-1512.
- Hayashi T., Rizzuto R., Hajnoczky G., et al. MAM: more than just a housekeeper. Trends Cell Biol. 2009; 19: 81–88.
- Ruscher K., Shamloo M., Rickhag M., et al. The sigma-1 receptor enhances brain plasticity and functional recovery after experimental stroke. Brain 2011; 134: 732–746.
- Tsai S.-Y., Hayashi T., Harvey B.K., et al. Sigma-1 receptors regulate hippocampal dendritic spine formation via a free radical-sensitive mechanism involving Rac1xGTP pathway. Proc. Natl. Acad. Sci. U.S.A. 2009; 106: 22468–22473.
- Endris V., Wogatzky B., Leimer U., et al. The novel Rho-GTPase activating gene MEGAP / srGAP3 has a putative role in severe mental retardation. Proc. Natl. Acad. Sci. U.S.A. 2002; 99: 11754–11759.
- Mueller B.H. 2nd, Park Y., Daudt D.R. 3rd, et al. Sigma-1 receptor stimulation attenuates calcium influx through activated L-type Voltage Gated Calcium Channels in purified retinal ganglion cells. Exp. Eye Res. 2013; 107: 21–31.
- Kourrich S., Su T.-P., Fujimoto M., et al. The sigma-1 receptor: roles in neuronal plasticity and disease. Trends Neurosci. 2012; 35: 762–771.
- Misgeld T., Schwarz T.L. Mitostasis in neurons: maintaining mitochondria in an extended cellular architecture. Neuron 2017; 96: 651–666.
- Daniels T.E., Olsen E.M., Tyrka A.R. Stress and psychiatric disorders: the role of mitochondria. Annu. Rev. Clin. Psychol. 2020; 16: 165–186.
- Allis C.D., Jenuwein T. The molecular hallmarks of epigenetic control. Nat. Rev. Genet. 2016; 17: 487–500.
- Bertogliat M.J., Morris-Blanco K.C., Vemuganti R. Epigenetic mechanisms of neurodegenerative diseases and acute brain injury. Neurochem. Int. 2020; 133: 104642.
- Weng T.-Y., Tsai S.-Y.A., Su T.-P. Roles of sigma-1 receptors on mitochondrial functions relevant to neurodegenerative diseases. J. Biomed. Sci. 2017; 24: 74.
- Kriaucionis S., Heintz N. The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain. Science 2009; 324: 929–930.
- Tahiliani M., Koh K.P., Shen Y., et al. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL Partner TET1. Science 2009; 324: 930–935.
- Shock L.S., Thakkar P.V., Peterson E.J., et al. DNA methyltransferase 1, cytosine methylation, and cytosine hydroxymethylation in mammalian mitochondria. Proc. Natl. Acad. Sci. U.S.A. 2011; 108: 3630–3635.
- Barile M., Brizio C., Valenti D., et al. The riboflavin/FAD cycle in rat liver mitochondria: Riboflavin/FAD cycle in RLM. Eur. J. Biochem. 2000; 267: 4888–4900.
- Berkich D.A., Xu Y., LaNoue K.F., et al. Evaluation of brain mitochondrial glutamate and alpha-ketoglutarate transport under physiologic conditions. J. Neurosci. Res. 2005; 79: 106–113.
- Gibson G.E., Starkov A., Blass J.P., et al. Cause and consequence: mitochondrial dysfunction initiates and propagates neuronal dysfunction, neuronal death and behavioral abnormalities in age-associated neurodegenerative diseases. Biochim. Biophys. Acta BBA – Mol. Basis Dis. 2010; 1802: 122–134.
- Singh K. Mitochondria damage checkpoint in apoptosis and genome stability. FEMS Yeast Res. 2004; 5: 127–132.
- Fagiolini M., Jensen C.L., Champagne F.A. Epigenetic influences on brain development and plasticity. Curr. Opin. Neurobiol. 2009; 19: 207–212.
- Jawaid A., Roszkowski M., Mansuy I.M. Transgenerational epigenetics of traumatic stress. Prog. Mol. Biol. Transl. Sci. 2018; 158: 273-298.
- Costa D.L., Yetter N., DeSomer H. Intergenerational transmission of paternal trauma among US Civil War ex-POWs. Proc. Natl. Acad. Sci. U.S.A. 2018; 115: 11215–11220.
- Kellermann N.P. Epigenetic transmission of Holocaust trauma: can nightmares be inherited? Isr. J. Psychiatry Relat. Sci. 2013; 50: 33-39.
- Yehuda R., Bierer L.M. The relevance of epigenetics to PTSD: implications for the DSM-V. J. Trauma. Stress 2009; 22: 427–434.
- Pérez-Mediavilla A., Zamarbide M. Maternal imprinting, mitochondrial DNA, nuclear DNA and Alzheimer’s disease. Explor. Neuroprot. Ther. 2021; 1: 121–126.
- Bai Q., Burton E.A. Zebrafish models of Tauopathy. Biochim. Biophys. Acta BBA – Mol. Basis Dis. (2011) 1812, 353–363.
- Das S., Rajanikant G.K. Huntington disease: Can a zebrafish trail leave more than a ripple? Neurosci. Biobehav. Rev. 2014; 45: 258–261.
- Laird A.S., Mackovski N., Rinkwitz S., et al. Tissue-specific models of spinal muscular atrophy confirm a critical role of SMN in motor neurons from embryonic to adult stages. Hum. Mol. Genet. 2016; 25: 1728–1738.
- Crouzier L., Denus M., Richard E.M., et al. Sigma-1 receptor is critical for mitochondrial activity and unfolded protein response in larval zebrafish. Int. J. Mol. Sci. 2021; 22: 11049.
- Batalla M. Therapeutic uses of all-natural 5-MeO-DMT enrichment from glandular secretion of Bufo alvarius toad from the Sonoran Desert. USPTO priority application number US63/415407; 2022.
- Yaden D.B., Newberg A.B. Mystical Experiences: Unity and Ego-Dissolution. Chapter 12. En: The Varieties of Spiritual Experience: 21st Century Research and Perspectives. Yaden D.B., Newberg A.B., Oxford University Press, págs. 224–C12.P140; 2022.
- Reckweg J.T., Uthaug M.V., Szabo A., et al. The clinical pharmacology and potential therapeutic applications of 5-methoxy-N,N-dimethyltryptamine (5-MeO-DMT). J. Neurochem. 2022; 162: 128–146.
- Lancelotta R.L., Davis A.K. Use of benefit enhancement strategies among 5-methoxy-N,N-dimethyltryptamine (5-MeO-DMT) users: associations with mystical, challenging, and enduring effects. J. Psychoactive Drugs 2020; 52: 273-281.
- Reckweg J., Mason N.L., van Leeuwen C., et al. A phase 1, dose-ranging study to assess safety and psychoactive effects of a vaporized 5-methoxy-N,N-dimethyltryptamine formulation (GH001) in healthy volunteers. Front. Pharmacol. 2021; 12: 760671.
- Moylan S., Maes M., Wray N.R., et al. The neuroprogressive nature of major depressive disorder: pathways to disease evolution and resistance, and therapeutic implications. Mol. Psychiatry 2013; 18: 595–606.
- Konradi C., Eaton M., MacDonald M.L., et al. Molecular evidence for mitochondrial dysfunction in bipolar disorder. Arch. Gen. Psychiatry 2004; 61: 300-308.
- Fattal O., Link J., Quinn K., et al. Psychiatric comorbidity in 36 adults with mitochondrial cytopathies. CNS Spectr. 2007; 12: 429–438.
- Zuccoli G.S., Saia-Cereda V.M., Nascimento J.M., et al. The energy metabolism dysfunction in psychiatric disorders postmortem brains: focus on proteomic evidence. Front. Neurosci. 2017; 11: 493.
- Tsai S.-Y.A., Chuang J.Y., Tsai M.S., et al. Sigma-1 receptor mediates cocaine-induced transcriptional regulation by recruiting chromatin-remodeling factors at the nuclear envelope. Proc. Natl. Acad. Sci. U.S.A. 2015; 112: E6562-E6570.
- Sha S., Qu W.J., Li L., et al. Sigma-1 receptor knockout impairs neurogenesis in dentate gyrus of adult hippocampus via down-regulation of NMDA receptors. CNS Neurosci. Ther. 2013; 19: 705–713.
- Uthaug M.V., Lancelotta R., van Oorsouw K., et al. A single inhalation of vapor from dried toad secretion containing 5-methoxy-N,N-dimethyltryptamine (5-MeO-DMT) in a naturalistic setting is related to sustained enhancement of satisfaction with life, mindfulness-related capacities, and a decrement of psychopathological symptoms. Psychopharmacology (Berl.) 2019; 236: 2653–2666.
- Davis A.K., Barsuglia J.P., Lancelotta R., et al. The epidemiology of 5-methoxy- N,N-dimethyltryptamine (5-MeO-DMT) use: Benefits, consequences, patterns of use, subjective effects, and reasons for consumption. J. Psychopharmacol. (Oxf.) 2018; 32: 779–792.
- Chiamulera C., Epping-Jordan M.P., Zocchi A., et al. Reinforcing and locomotor stimulant effects of cocaine are absent in mGluR5 null mutant mice. Nat. Neurosci. 2001; 4: 873–874.
- Bird M.K., Kirchhoff J., Djouma E., et al. Metabotropic glutamate 5 receptors regulate sensitivity to ethanol in mice. Int. J. Neuropsychopharmacol. 2008; 11: 765-774.
- Barsuglia J.P., Polanco M., Palmer R., et al. A case report SPECT study and theoretical rationale for the sequential administration of ibogaine and 5-MeO-DMT in the treatment of alcohol use disorder. Prog. Brain Res. 2018; 242: 121–158.
- Inserra A. Hypothesis: the psychedelic Ayahuasca heals traumatic memories via a sigma 1 receptor-mediated epigenetic-mnemonic process. Front. Pharmacol. 2018; 9: 330.
- Davis A.K., Averill L.A., Sepeda N.D., et al. Psychedelic treatment for trauma-related psychological and cognitive impairment among US Special Operations Forces Veterans. Chronic Stress (Thousand Oaks) 2020; 4: 247054702093956.
- Kourrich S., Su T.-P., Fujimoto M., et al. The sigma-1 receptor: roles in neuronal plasticity and disease. Trends Neurosci. 2012; 35: 762–771.
- Ben-Shachar D., Karry R. Neuroanatomical pattern of mitochondrial complex I pathology varies between schizophrenia, bipolar disorder and major depression. PLoS ONE 2008; 3: e3676.
- Tsai S.-Y.A., Pokrass M.J., Klauer N.R., et al. Sigma-1 receptor chaperones in neurodegenerative and psychiatric disorders. Expert Opin. Ther. Targets 2014; 18: 1461-1476.
Declaración de conflicto de intereses: La autora es la inventora de la aplicación de patente provisional que describe los usos terapéuticos del 5-MeO-DMT totalmente natural.
Cita reciente1: Impacto terapéutico en enfermedades mentales y neurodegenerativas de la 5-metoxi-N, N-dimetiltriptamina natural (5-MeO-DMT), agonista farmacológico del receptor sigma-1 a través de la activación mitocondrial, Milena Batalla, autora en La Revista Anales de la Asociación Química Argentina, Vol.110 N°2, pág. 33 – 59. 23 de diciembre de 2023.
Cita reciente2: Batalla M. All-natural 5-MeO-DMT sigma receptor 1 agonist and its therapeutic impact in mental and neurodegenerative diseases through mitochondrial activation. Science Reviews – Biology 2023; 2 (2): 1-20. https://doi.org/10.57098/SciRevs.Biology.2.2.1
Los puntos de vista y opiniones expresados en este artículo son de exclusiva responsabilidad de los autores y no reflejan necesariamente las de la revista ni del equipo editorial.




